Лечение плазмой, богатой факторами роста (PRGF-Endoret®) для регенерации эндометрия
PRGF-Endoret® для регенерации эндометрия
Плазма, богатая факторами роста (PRGF), изготавливается из собственной крови пациента.
PRGF готовится по закрытой системе PRGF-Endoret®, разработанной компанией BTI Biotechnology, и представляет собой биомедицинскую технологию, направленную на стимуляцию восстановления тканей с помощью факторов роста и других белков, содержащихся в плазме крови.
Факторы роста, содержащиеся в тромбоцитах — это набор белков, участвующих в клеточной коммуникации и влияющих на биологические ответы клеток. Такой тип терапии широко применяется в медицине и стоматологии и основан на регенеративном подходе, имитирующем естественные процессы восстановления тканей организма.
Показания к применению в эндометрии
Тонкий эндометрий — это состояние, при котором внутренний слой матки, в который имплантируется эмбрион, недостаточно растет даже при адекватной гормональной терапии. Если эндометрий не растет должным образом, связь между эндометрием и предварительно подготовленным эмбрионом нарушается, что препятствует нормальному развитию эмбриона. Тонкий эндометрий диагностируется при ультразвуковом измерении толщины эндометрия, которая должна составлять не менее 6–7 мм после 10-дневной гормональной терапии эстрогеном. Научные исследования показывают, что PRGF способствует росту эндометрия, улучшает состояние поврежденного эндометрия и повышает шансы на успешную беременность.
Альтернативы терапии
Тонкий эндометрий сложно лечить, и в настоящее время описано мало эффективных альтернатив (витамин E, вагинальный цитрат силденафила и пентоксифиллин), ни одна из которых не имеет достаточных научных доказательств эффективности.
Процедура
- После 10-дневной гормональной терапии, если эндометрий не достигает нужной толщины, у пациента берут образец крови.
- Кровь обрабатывается по протоколу закрытой системы PRGF-Endoret®.
- Существует два способа введения:
- Амбулаторное введение в эндометрий:
- Делится на три этапа: первая свежая инъекция и две последующие замороженные для последующего капельного введения в эндометрий (через 48 и 96 часов после первой инъекции)
- Введение в эндометрий — простая и безболезненная процедура, выполняемая в кабинете врача или в комнате для переноса эмбриона через влагалище с использованием вагинального зеркала и канюли для переноса эмбриона.
- Гистероскопия и субэндометриальные инъекции:
- Одноразовая процедура, при которой PRGF вводят в эндометрий мелкими инъекциями на несколько миллиметров глубиной. Процедура всегда сопровождается диагностической гистероскопией, позволяющей точно определить место и глубину инъекции.
- Субэндометриальный способ направлен на воздействие на стволовые и предшественнические клетки, стимулируя рост и васкуляризацию, что подтверждено гистологическими изменениями эндометрия.
- После процедуры пациент может продолжать обычный образ жизни.
- Амбулаторное введение в эндометрий:
Противопоказания
Существуют определенные состояния, при которых не рекомендуется проводить лечение эндометрия из-за потенциального риска ухудшения этих состояний:
- Текущее или ранее перенесенное воспалительное заболевание органов малого таза.
- Инфекция, острые инфекции половых органов.
- Любая патология, которая, по мнению врача, представляет риск или противопоказание.
- Беременность противопоказана.
- Положительные анализы на HBsAg, HBcAb, HCV, HIV и сифилис.
Риски
Терапия является аутологичной, то есть используется собственная кровь пациента, что минимизирует риск иммунной реакции.
Закрытая система исключает риск загрязнения.
В литературе не описаны побочные эффекты этой процедуры.
Теоретический риск инфекции при введении через влагалище сопоставим с риском при внутриматочной инсеминации или переносе эмбриона и минимизируется профилактическими антибиотиками.
Хотя долгосрочные осложнения не выявлены, микро травматизация на субэндометриальном уровне может способствовать развитию эндометриоза или аденомиоза.
Исполнитель услуги
Лечение плазмой, богатой факторами роста (PRGF-Endoret®) для регенерации яичников
Плазма, богатая факторами роста (PRGF), изготавливается из собственной крови пациента.
PRGF готовится по закрытой системе PRGF-Endoret®, разработанной компанией BTI Biotechnology, и представляет собой биомедицинскую технологию, направленную на стимуляцию восстановления тканей с помощью факторов роста и других белков, содержащихся в плазме крови.
Факторы роста, содержащиеся в тромбоцитах — это набор белков, участвующих в клеточной коммуникации и влияющих на биологические ответы клеток. Такой тип терапии широко применяется в медицине и стоматологии и основан на регенеративном подходе, имитирующем естественные процессы восстановления тканей организма.
Показания и целесообразность применения при старении яичников
Старение яичников — это термин, описывающий различные патологические состояния, при которых функция яичников снижена. У женщин с резко уменьшенным овариальным резервом возможен слабый ответ на стимуляцию яичников при ЭКО, что приводит к получению небольшого количества или низкокачественных ооцитов.
Эффективность подобных методов зависит от наличия качественных эмбрионов, поэтому репродуктивный потенциал таких пациенток ограничен.
Введение плазмы, обогащённой факторами роста, непосредственно в яичники является новаторским подходом в репродуктивной медицине и в рамках регенеративной медицины показало многообещающие результаты, улучшая функцию яичников и повышая эффективность ЭКО.
Альтернативы введению PRGF
Старение яичников — физиологический процесс, связанный с уменьшением количества и качества ооцитов, что влияет на фертильность. Существуют различные факторы, влияющие на функцию яичников: возраст женщины, генетические и экологические факторы.
Доступные методы включают специализированные стратегии ЭКО с собственными ооцитами, а при недостаточной эффективности — донорство гамет или усыновление.
Процедура:
- Проверка соответствия критериям для получения лечения.
- Обработка крови по протоколу закрытой системы PRGF-Endoret®.
- Трансвагинальное введение определённого объёма плазмы, обогащённой факторами роста, под ультразвуковым контролем и под наркозом.
- После процедуры пациентка находится под наблюдением 30–40 минут и может быть выписана амбулаторно. Далее можно вести обычный образ жизни.
Противопоказания
- Генетическая недостаточность яичников.
- Злокачественные опухоли яичников в анамнезе.
- Любая патология, представляющая риск для пациентки.
- Противопоказание к беременности.
Необходимо информировать врача обо всех состояниях здоровья и принимаемых препаратах.
Риски
Терапия является аутологичной (используется собственная кровь пациентки), что исключает реакции на чужеродный клеточный материал.
Риски схожи с пункцией яичников: кровотечение, травма органов малого таза (мочевой пузырь, кишечник, сосуды), воспаление, перекрут яичников. Вероятность осложнений выше при спайках после предыдущих операций, аутоиммунных, инфекционных или эндокринных заболеваниях.
При проколе кожи или слизистых существует минимальный риск инфекции или кровотечения. Процедура проводится под наркозом, пациентка не испытывает боли. Система закрытая, риск заражения отсутствует.
В литературе не описаны побочные эффекты или риски, связанные с этой процедурой.
Исполнитель услуги
Какой тест CGT подходит вам?
CGT Bank – подходит для исследования донорских половых клеток, панель охватывает секвенирование 71 гена (7 аутосомных + 64 X-связанных гена), выявляет до 75 генетических заболеваний.
CGT Plus – подходит для обследования пациентов, панель охватывает секвенирование 519 генов (455 аутосомных + 64 X-связанных гена), выявляет до 570 генетических заболеваний.
CGT Exome – подходит для обследования пациентов, панель охватывает секвенирование 2276 генов (2084 аутосомных + 192 X-связанных гена), выявляет более 2300 генетических заболеваний.
Для проведения теста требуется 5 мл венозной крови от обследуемого.
Зачем делать тест на генетическую совместимость?
Родители часто узнают о том, что являются носителями серьёзного генетического заболевания только после рождения больного ребёнка. Генетические болезни можно предотвратить, но вылечить их нельзя. CGT — единственный клинически валидный тест для оценки рисков.
Кому показан тест на генетическую совместимость?
У всех людей есть генетические вариации, и CGT позволяет определить, могут ли они привести к заболеваниям у будущих детей.
Рекомендуется в следующих случаях:
- Перед планированием естественного зачатия — для женщин, желающих заранее узнать о возможных рисках передачи заболеваний ребёнку.
- Перед использованием вспомогательных репродуктивных технологий (ВРТ, включая ЭКО) — для оценки рисков передачи заболеваний и выбора оптимальной тактики.
- Перед использованием донорской спермы или яйцеклеток — чтобы выбрать донора без тех же мутаций, что и у получателя донорских клеток.
CGT позволяет семье получить информацию о рисках ещё на этапе планирования беременности и определить необходимость дополнительных обследований эмбриона/плода, таких как амниоцентез или хорионбиопсия.
Что показывает тест на генетическую совместимость?
Тест не сообщает о конкретных заболеваниях будущего ребёнка, а даёт сведения о проверенных генах и связанных с ними заболеваниях.
Тест помогает определить риск рождения ребёнка с генетическим заболеванием. Даже если оба родителя здоровы и имеют здорового ребёнка, наличие одинаковой мутации у обоих может привести к заболеванию следующего ребёнка. Один или несколько здоровых детей не исключают риск для следующего ребёнка.
Тест не гарантирует рождения здорового ребёнка, так как оценивает только риски некоторых моногенных заболеваний. Он не охватывает все генетические и хромосомные болезни.
Результаты помогают спланировать дальнейшие действия, например, тест Panorama, хорионбиопсия, амниоцентез или ПГД/ПГС перед переносом эмбрионов. Это профилактическая медицина, аналогичная PAP-тесту для женщин, который рекомендуется каждые 2–3 года, хотя рак шейки матки встречается менее чем у 1% женщин. Моногенные заболевания встречаются примерно у 1% живорождённых детей, а у ~8% пар существует опасная комбинация генов для таких заболеваний.
Сроки и стоимость: Результаты доступны примерно через 4 недели.
Стоимость теста, включая так называемое сопоставление (письменную информацию о рисках и пригодности)
| Название | Цена |
|---|---|
Минимально рекомендовано для использования донорских половых клеток 575 EUR (донор) + 575 EUR (партнер, использующий донора) | 1150€ |
Рекомендуется пациентам перед планированием беременности (CGT Plus) 650 EUR (женщина) + 650 EUR (мужчина) | 1300€ |
Рекомендуется пациентам перед планированием беременности (CGT Exome) 1000 EUR (женщина) + 1000 EUR (мужчина) | 2000€ |
Тест CGTPlus и тест CGT Exome также могут использоваться в программах донорства.
К стоимости добавляется консультация гинеколога.
Особенности: Тестирование только одной стороны не даёт полной информации, так как все
люди являются носителями рецессивных дефектных генов (обычно 3–4 различных рецессивных гена на человека). Важно определить, является ли общий ребёнок носителем мутации или болен.
Если оба партнёра являются носителями одинаковой мутации, возможны следующие варианты:
- ЭКО с ПГД/ПГС, перенос только здоровых эмбрионов.
- Дополнительное тестирование во время беременности – Panorama-тест или хорионбиопсия/амниоцентез для диагностики определённых заболеваний.
| Запросите информацию и запишитесь на приём | |
|---|---|
Записаться по электронной почте | |
Записаться по телефону |
Генетическое заболевание on это болезнь, вызванная изменениями в ДНК индивида. В результате мутации происходит изменение последовательности ДНК в гене, и соответствующий ген перестаёт кодировать нормально функционирующий белок. Функции белка, необходимые для нормальной жизнедеятельности организма, нарушаются, что приводит к развитию болезни.
Ошибка в последовательности ДНК, или мутация может варьироваться от одиночного нуклеотидного изменения до более масштабных изменений хромосомного набора. Большинство генетических заболеваний довольно редки и затрагивают лишь одного человека из нескольких тысяч или даже миллионов.
Генетические болезни могут быть наследственными, переданными от родителей, или ненаследственными. В случае наследственных заболеваний мутации происходят в зародышевой линии (клетки, из которых образуются половые клетки), что участвует в передаче генетической информации от родителей потомкам. Ненаследственные заболевания могут возникать из-за новых мутаций или изменений ДНК соматических клеток. Одно и то же заболевание, например определённая форма рака, может быть вызвано как наследственными факторами, так и новыми мутациями или воздействием
окружающей среды. Тяжесть и проявления болезни зависят почти всегда от факторов окружающей среды и индивидуального развития человека.
Существуют три типа генетических заболеваний:
- Моногенные заболевания, когда мутация затрагивает один ген;
- Хромосомные заболевания, когда хромосомы (переносящие наследственную информацию в ядре клетки) или их части отсутствуют или изменены;
- Полигенные заболевания, когда мутации присутствуют в двух или более генах, а также важную роль играют образ жизни и окружающая среда.
Если пара, где один или оба партнёра являются носителями или больны моногенным заболеванием, желает иметь ребёнка, они могут использовать экстракорпоральное оплодотворение (ЭКО). Это позволяет провести преимплантационную диагностику, чтобы определить вероятность заболевания эмбриона.
| Генетические заболевания | их распространённость |
|---|---|
| Гиперхолестеринемия | 1 из 500 |
| Серповидноклеточная анемия | 1 из 625 |
| Муковисцидоз | 1 из 2000 |
| Болезнь Тея–Сакса | 1 из 3000 |
| Гемофилия | 1 из 10 000 |
| Дюшенновская мышечная дистрофия | 1 из 7000 |
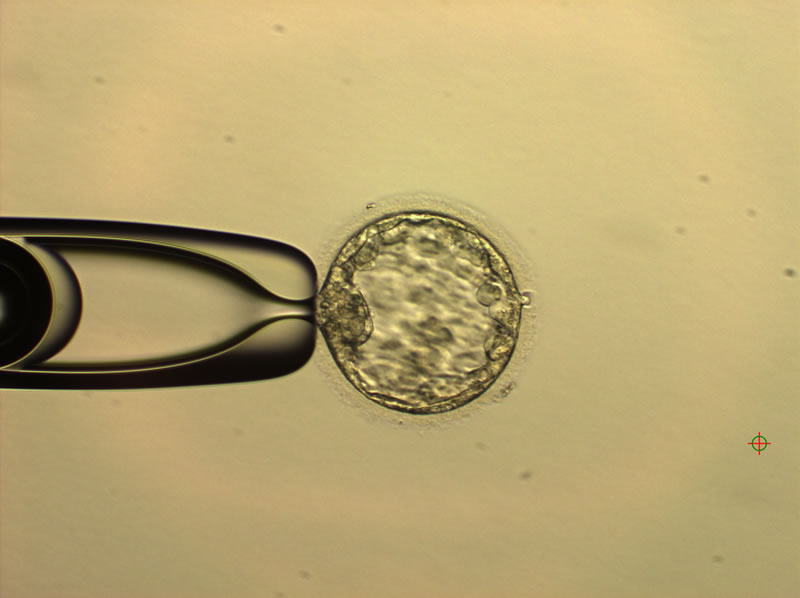
Значительная роль в процессах оплодотворения и имплантации (внедрения) принадлежит «Zona Pellucida» (ZP). ZP — это слой гликопротеинов, окружающий яйцеклетку млекопитающих, формирование которого зависит как от первичных фолликулярных клеток, так и от первичной ооциты (клетки, проходящей два деления и формирующей яйцеклетку).
Две основные функции ZP — контролировать процесс оплодотворения и защищать эмбрион на ранних стадиях деления.
Во время оплодотворения ZP действует как механический и селективный барьер для сперматозоидов, а после слияния гамет выполняет функцию своеобразной «крепости», внутри которой эмбрион защищен от микроорганизмов, вирусов и иммунных клеток, развиваясь до стадии компактной морулы.
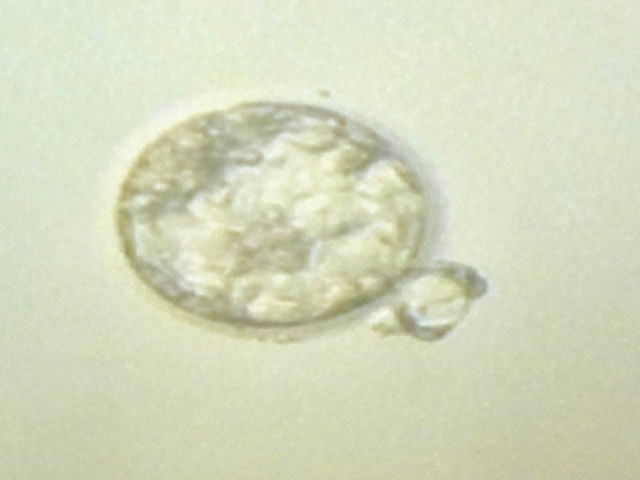
Эмбрион млекопитающих окружен ZP до стадии бластocисты. Перед имплантацией эмбрион выходит из ZP — этот процесс называется «hatching» (вылупление).
Вылупление эмбриона (ВЭ) — это процесс, при котором растущая бластocиста проходит циклы увеличения и уменьшения размеров, индуцируя прогрессивное пластическое деформирование матрицы ZP.
Когда деформация ZP достигает максимума, происходит локальное разрушение матрицы, и бластocиста выходит из ZP.
Если этот процесс не происходит корректно, имплантация не осуществляется и беременность не наступает. Любое функциональное или структурное нарушение ZP может привести к отсутствию или неполному вылуплению.
Возможные причины отсутствия вылупления делят на две основные категории:
- У эмбрионов с толстой ZP (>20 мкм) снижается способность пройти вылупление и имплантироваться. Толщина ZP коррелирует с возрастом пациентки (>35 лет), высоким уровнем базального FSH на 3-й день менструального цикла и уровнем эстрадиола перед овуляцией.
- Инвитро-культивирование эмбрионов в искусственной среде, обработка гиалуронидазой для удаления «corona radiata» и криоконсервация эмбрионов вызывают «уплотнение» ZP.
Для решения проблем с вылуплением J. Cohen и соавторы предложили искусственно создавать отверстие в ZP эмбриона перед переносом.
Этот метод называется ассистированным вылуплением (АВ, assisted hatching) и направлен на обеспечение эффективного вылупления через созданное отверстие.
В естественном процессе вылупление связано с пластическим деформированием ZP под ростом бластocисты до разрыва в самой слабой точке; при предварительном отверстии необходимость в пластическом деформировании отпадает.
Во время экспансии бластocисты эмбриональные клетки выходят через созданное отверстие, формируя восьмеркообразную промежуточную форму, как при естественном вылуплении. Отсутствие оставшихся бластocист в «мешочке» ZP указывает на то, что механизм ВЭ контролируется самим эмбрионом на финальной стадии.
Для АВ использовались различные методы: изначально — механическое частичное рассечение ZP с использованием стеклянной капиллярной иглы, позже — химическое открытие ZP кислотным раствором Tyrode («ZP drilling»), применяемое до сих пор. Оба метода требуют высокой точности и времени. Механические подходы создают отверстия разного размера, что может быть вредно для целостности эмбриона. Химическое открытие Tyrode обеспечивает более стандартные отверстия, но требует высокой квалификации и потенциально снижает жизнеспособность эмбрионов.
Поиск более эффективного и безопасного метода имплантации привел к появлению лазерных систем различной длины волны и принципа действия, применяемых для манипуляции ZP перед имплантацией.
Наиболее широко используется современный бесконтактный инфракрасный диодный лазер 1,48 мкм, который обеспечивает отличную манипуляцию ZP. Лазер проходит через объектив микроскопа, легко фокусируется и позволяет бесконтактное воздействие. ZP можно открыть мгновенно одним импульсом.
Преимущество такой длины волны — низкая абсорбция в воде и достаточное поглощение для создания необходимых тканевых эффектов. Процедура возможна в пластиковых чашках и питательных средах, упрощая работу с эмбрионами. Время воздействия короткое (до 50 мс), что устраняет необходимость удерживать яйцеклетку микроманипулятором.
Трансмиссионная электронная микроскопия не выявляет изменений в матрице ZP или цитоплазме яйцеклетки.
Большинство ретроспективных исследований показывают, что АВ повышает как имплантацию, так и клиническую частоту беременности у выбранной группы пациентов.
Рандомизированные исследования некоторых популяций указывают на отсутствие значимого эффекта АВ на имплантацию и клиническую беременность, однако оба типа исследований подтверждают эффективность АВ у подгрупп пациенток с плохим прогнозом.
Прогностические критерии для АВ: возраст >35 лет, высокий базальный FSH на 3-й день цикла, криоконсервация перед переносом, повторные неудачи ВЭ и толстая ZP (>20 мкм).
Считается, что АВ может улучшать имплантацию эмбриона не только механически, но и за счет более раннего контакта эмбриона с эндометрием, что важно для синхронности развития эмбриона и контакта с маткой.
Исполнители услуги
Стоимость
| Услуга | Цена |
|---|---|
Assisted hatching лазером (открытие «Zona Pellucida» эмбрионов лазером) | 500 € |
| Бронирование | |
|---|---|
Забронировать через самообслуживание |